|
ไอโอดีน-131 (131I) อาจจะเรียกว่า นิวไคลด์รังสี เป็นไอโซโทปรังสีที่สำคัญของไอโอดีน ซึ่งเป็นธาตุที่มีหลายไอโซโทปรังสี ไอโอดีน-131 สลายตัวโดยมีครึ่งชีวิตประมาณ 8 วัน มีการนำมาใช้ประโยชน์ทางการแพทย์ และเป็นไอโซโทปรังสีที่มีอันตรายที่เกิดจากปฏิกิริยานิวเคลียร์ฟิชชัน เนื่องจากเป็นไอโซโทปที่มีผลต่อสุขภาพเมื่อแพร่ไปในอากาศ เช่น การทดลองระเบิดปรมาณูเมื่อปี 1950 และอุบัติเหตุที่เชอร์โนบิล รวมทั้งอุบัติเหตุที่โรงไฟฟ้านิวเคลียร์ฟูกูชิมาของญี่ปุ่น เนื่องจากไอโอดีน-131 เป็นไอโซโทปหลักอย่างหนึ่งที่เป็นผลผลิตฟิชชันโดยตรงของยูเรเนียมกับพลูโตเนียม และเกิดจากผลผลิตฟิชชันของทอเรียม โดยมีปริมาณเกือบ 3% โดยน้ำหนักของผลผลิตฟิชชันทั้งหมด |
||||||||||||
|
||||||||||||
|
ไอโอดีน-131 สลายตัวให้รังสีบีต้า ซึ่งสามารถทำให้เซลล์ตายลง หรือเกิดการกลายพันธุ์ (mutation) ได้ เนื่องจากอนุภาคบีต้าจะเคลื่อนที่ผ่านเซลล์ต่างๆ ได้เป็นระยะทางหลายมิลลิเมตร บางครั้งการได้รับรังสีปริมาณต่ำกว่ากลับมีอันตรายมากกว่าได้รับรังสีปริมาณสูง เช่น เมื่อเข้าไปในต่อมไทรอยด์ รังสีปริมาณสูงจะทำให้เซลล์ของไทรอยด์ตายลง แต่การได้รับรังสีปริมาณต่ำกว่าทำให้เซลล์กลายเป็นมะเร็ง ตัวอย่างเด็กคนหนึ่ง ได้รับไอโอดีน-131 ปริมาณปานกลาง เพื่อรักษาเนื้องอกของไทรอยด์กลับพบว่าไทรอยด์เป็นมะเร็งมากขึ้น แต่เมื่อเด็กคนนี้ได้รับรังสีจากไอโอดีน-131 ในปริมาณสูงกลับไม่เป็น ในทำนองเดียวกัน จากการศึกษาการรักษาคอพอก (Graves disease) ด้วยไอโอดีน-131 ปริมาณสูง ไม่พบว่าเป็นมะเร็งของไทรอยด์เพิ่มขึ้น ทั้งๆ ที่ความเสี่ยงในการเป็นมะเร็งไทรอยด์แปรผันแบบเชิงเส้นกับการได้รับรังสีจากไอโอดีน-131 ระดับปานกลาง ดังนั้น การปรับเพิ่มไอโอดีน-131 ปริมาณต่ำๆ จึงไม่ให้ผลดีในการรักษา โดยเฉพาะในเด็ก แต่การปรับเพิ่มขึ้นจะใช้ในกรณีที่ใช้กับก้อนเนื้อขนาดใหญ่ หรือต้องใช้รังสีปริมาณมากเพื่อทำลายเนื้อเยื่อของเซลล์ เราสามารถเห็นไอโอดีน-131 ได้ด้วยเทคนิคการถ่ายภาพทางเวชศาสตร์นิวเคลียร์ (nuclear medicine) เช่น การใช้กล้องรังสีแกมมา (gamma cameras) ในการรักษา เนื่องจาก 10% ของรังสีจากไอโอดีน-131 เป็นรังสีแกมมา ขณะที่อีก 90% เป็นรังสีบีต้าที่ทำลายเซลล์โดยไม่มีผลต่อการเห็นภาพ ส่วนไอโซโทปอื่นของไอโอดีนจะใช้สำหรับการถ่ายภาพด้วยเทคนิคทางนิวเคลียร์ (nuclear imaging) เท่านั้น แต่โดยทั่วไปมักจะใช้ไอโอดีน-131 ในงานวินิจฉัย เช่นการถ่ายภาพ เนื่องจากมีราคาต่ำกว่าไอโซโทปอื่นของไอโอดีน การถ่ายภาพรังสีทางการแพทย์ (medical imaging) ด้วยไอโอดีน-131 ใช้ปริมาณเพียงเล็กน้อยซึ่งไม่มีผลที่จะทำให้มีโอกาสเป็นมะเร็งสูงขึ้น และการที่ไอโอดีน-131 มีราคาไม่สูง เนื่องจากการผลิตทำได้ง่ายกว่า โดยการยิงด้วยธาตุเทลลูเรียม (tellurium) ด้วยนิวตรอนในเครื่องปฏิกรณ์นิวเคลียร์ แล้วแยกไอโอดีน-131 ออกมา ซึ่งทำได้หลายวิธี เช่น การให้ความร้อนเพื่อให้ไอโอดีนระเหย แต่ไอโซโทปอื่นของไอโอดีนมักจะต้องใช้เทคนิคที่มีต้นทุนสูงกว่ามาก โดยเริ่มต้นจากการนำก๊าซซีนอน (xenon) บรรจุในหลอดความดันไปฉายรังสีจากเครื่องปฏิกรณ์นิวเคลียร์ |
||||||||||||
|
||||||||||||
| ปริมาณไอโอดีน-131 ที่ใช้ในการรักษาทางการแพทย์สูงกว่าปริมาณไอโอดีน-131 ที่ทำให้มีโอกาสเป็นมะเร็งของต่อมไทรอยด์สูงขึ้นมาก เช่น ในกรณีที่ได้รับจากการปนเปื้อนเมื่อเกิดอุบัติเหตุทางนิวเคลียร์ ทำให้เนื้อเยื่อได้รับความเสียหายจากไอโอดีน-131 ซึ่งมักจะแสดงอาการเมื่อเวลาผ่านไปแล้วเป็นปี ซึ่งไอโอดีน-131 ได้สลายตัวหมดไปแล้ว | ||||||||||||
|
||||||||||||
|
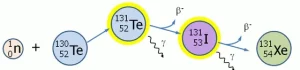
การผลิต ไอโอดีน-131 ส่วนใหญ่ผลิตจากเครื่องปฏิกรณ์นิวเคลียร์ โดยการอาบเทลลูเรียมธรรมชาติด้วยนิวตรอน (neutron-irradiation) ซึ่งเกือบทั้งหมดจะได้ไอโอดีน-131 ที่เป็นนิวไคลด์กัมมันตรังสี มีครึ่งชีวิตมากกว่าชั่วโมง ส่วนไอโซโทปที่เบากว่าของเทลลูเรียม จะกลายเป็นไอโซโทปที่หนักมากขึ้นและมีสถานะเสถียร หรือกลายเป็นไอโซโทปเสถียรของไอโอดีนและซีนอน นิวไคลด์เทลลูเรียมธรรมชาติที่หนักที่สุด ได้แก่ Te-130 (มีสัดส่วน 30%) เมื่อได้รับนิวตรอนจะกลายเป็นเทลลูเรียม-131 มีครึ่งชีวิต 25 นาที และสลายตัวเป็นไอโอดีน-131 สารประกอบเทลลูเรียมที่อาบนิวตรอน จะอยู่ในรูปของสารประกอบออกไซด์ เมื่อผ่านเครื่องแลกเปลี่ยนไอออน (ion exchange column) จะแยกไอโอดีน-131 ออกมา จากนั้นจึงชะเพื่อแยกออกมาด้วยสารละลายอัลคาไลน์ (alkaline solution) อีกวิธีหนึ่งเป็นการอาบนิวตรอนผงเทลลูเรียมแล้วแยกไอโอดีน-131 ออกมาโดยการกลั่นแบบแห้ง (dry distillation) ด้วยการใช้ความดันไอต่ำๆ จากนั้นจึงละลายไอโอดีนในสารละลายอัลคาไลน์ตามวิธีมาตรฐาน ซึ่งจะได้ไอโอดีน-131 ในรูปของไอโอไดด์ (iodide) และไฮโปไอโอเดท (hypoiodate) ที่จะรีดิวซ์เป็นไอโอไดด์อีกครั้ง การสลายตัวของกัมมันตภาพรังสี (Radioactive decay) |
||||||||||||
|
||||||||||||
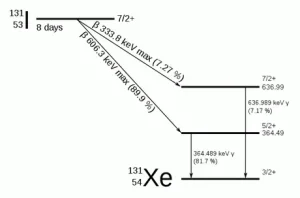
| นิวไคลด์กัมมันตรังสีของไอโอดีน-131 มี 78 นิวตรอนในนิวเคลียส ขณะที่นิวไคลด์เสถียรของไอโอดีน-127 มี 74 นิวตรอน ไอโอดีน-131 มีครึ่งชีวิต 8 วัน โดยการสลายตัวจะให้รังสีแกมมาต่อจากรังสีบีต้า แล้วกลายเป็นไอโซโทปเสถียรของซีนอน-131 (131Xe) | ||||||||||||
|
|
||||||||||||
|
การสลายตัวของไอโอดีน-131 ส่วนใหญ่จะให้รังสีบีต้าพลังงาน 606 keV (89%) และรังสีแกมมาพลังงาน 364 keV (81%) ส่วนที่เหลือเป็นรังสีบีต้าพลังงาน 248 – 807 keV กับรังสีแกมมาพลังงาน 723 keV นอกจากนั้นพลังงานส่วนเหลือจะทำให้เกิดแอนตินิวตริโน (antineutrino) ซึ่งมักเกิดร่วมกับกระบวนสลายตัวให้รังสีบีต้า อนุภาคบีต้าจากการสลายตัวมีพลังงานสูง จึงสามารถเคลื่อนที่เข้าไปเนื้อเยื่อได้ลึกประมาณ 0.6 – 2 มิลลิเมตร ไอโอดีน-131 เป็นผลผลิตฟิชชันซึ่งมีประมาณ 2.878% ของการเกิดฟิชชันของยูเรเนียม-235 จึงอาจมีการปลดปล่อยออกมาจากการทดลองอาวุธนิวเคลียร์หรือการเกิดอุบัติเหตุทางนิวเคลียร์ การที่ไอโอดีน-131 มีครึ่งชีวิตสั้นจึงไม่ควรจะตรวจพบในเชื้อเพิงนิวเคลียร์ใช้แล้ว ซึ่งจะต่างจากไอโอดีน-129 ที่มีครึ่งชีวิตมากกว่าเกือบพันล้านเท่า |
||||||||||||
|
||||||||||||
|
ผลจากการได้รับรังสี ถ้าไอโอดีน-131 ในสิ่งแวดล้อมมีระดับสูงขึ้นจากฝุ่นกัมมันตรังสี (fallout) จะถูกดูดซึมและปนเปื้อนในอาหาร เมื่อร่างกายได้รับจะไปสะสมเพื่อใช้งานที่ต่อมไทรอยด์ ซึ่งอาจเป็นอันตรายต่อต่อมไทรอยด์ ถ้าระดับของไอโอดีน-131 มีปริมาณสูง รังสีจากการสลายตัวอาจทำให้เกิดมะเร็งของต่อมไทรอยด์ในภายหลัง หรืออาจทำให้มีอาการไทรอยด์เป็นพิษ (thyroiditis) ในช่วงเวลาที่ได้รับรังสี คนที่อายุมากกว่าจะมีความเสี่ยงที่จะเป็นมะเร็งในภายหลังน้อยกว่า จากผลการศึกษาความเสี่ยงส่วนใหญ่จะเกิดกับเด็กและวัยรุ่น ในกรณีที่ผู้ใหญ่ได้รับรังสี พบว่าไม่มีความแตกต่างอย่างมีนัยสำคัญทางสถิติ เมื่อเทียบกับกลุ่มปกติที่ไม่ได้รับรังสี ความเสี่ยงในการได้รับรังสีจากไอโอดีน-131 สามารถลดลงได้โดยการรับไอโอดีนเข้าไปก่อน เพื่อเพิ่มปริมาณรวมของไอโอดีนในร่างกาย เป็นการลดการรับเข้าและปิดกั้นไอโอดีนที่มีกัมมันตภาพรังสี แต่ในกรณีของอุบัติเหตุที่เชอร์โนบิลนั้น ประชาชนที่อาศัยอยู่ใกล้กับโรงไฟฟ้าไม่ได้ไอโอดีน ขณะที่เด็กประเทศโปแลนด์ได้รับการแจกจ่ายไอโอดีนอย่างทั่วถึง |
||||||||||||
|
||||||||||||
|
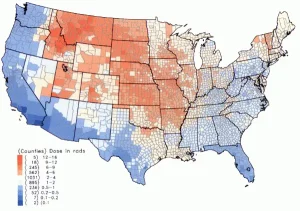
ในสหรัฐอเมริกา ปริมาณรังสีจากฝุ่นกัมมันตรังสี มีระดับสูงสุดในช่วงทศวรรษ 1950 และช่วงต้นของ 1960 ทำให้เด็กได้รับนมสดที่ปนเปื้อนกัมมันตรังสี จากการทดลองอาวุธนิวเคลียร์ สถาบันมะเร็งแห่งชาติของอเมริกา ได้ติดตามข้อมูลของผู้ได้รับผลของรังสีต่อสุขภาพจากไอโอดีน-131 ในฝุ่นกัมมันตรังสี (fallout) สำหรับผู้ที่เกิดก่อนปี 1971 ใน 3070 เมืองของอเมริกา การคำนวณได้ใช้การเก็บข้อมูลของฝุ่นกัมมันตรังสีจากการทดลองอาวุธนิวเคลียร์ที่ศูนย์ทดลองเนวาดา (Nevada Test Site) อุบัติเหตุที่โรงไฟฟ้านิวเคลียร์ฟูกูชิมา โรงที่ 1 เมื่อเดือนมีนาคม 2011 ทำให้ระดับของไอโอดีน-131 ในอาหารมีค่าสูงขึ้นอย่างมีนัยสำคัย ทั้งในผักขมและน้ำประปา ระดับรังสีที่สูงขึ้นนี้ ตรวจวัดได้ทั้งในบริเวณใกล้เคียงกับโรงไฟฟ้าและในบริเวณที่ห่างไกลออกไป เช่น กรุงโตเกียว จากค่าที่บันทึกที่โรงกรองน้ำของโตเกียว เมื่อวันที่ 27 มีนาคม 2011 ระดับรังสีขึ้นสูงที่ระดับ 190 เบคเคอเรลต่อลิตร หน่วยงานสาธารณสุขของรัฐแมสซาชูเสท (Massachusetts Department of Public Health) รายงานว่าได้ตรวจพบไอโอดีน-131 ในตัวอย่างน้ำฝนที่เก็บที่รัฐ Massachusetts สหรัฐอเมริกา ซึ่งคาดว่าอาจจะมาจากโรงไฟฟ้านิวเคลียร์ฟูกูชิมา การป้องกันและการรักษา |
||||||||||||
| วิธีการป้องกันการได้รับไอโอดีน-131 ทำได้โดยการทำให้ปริมาณไอโอดีนในร่างกายอิ่มตัว โดยการรับประทานไอโอดีน-127 ที่ไม่มีกัมมันตภาพรังสี โดยใช้ในรูปของเกลือไอโอดีน เพื่อทำให้ระดับไอโอดีนในร่างกายอิ่มตัว ไม่ควรใช้ธาตุไอโอดีนเดี่ยวๆ เนื่องจากเกิดออกซิเดชันได้ง่าย ทำให้มีฤทธิ์กัดกร่อน และเป็นพิษต่อทางเดินอาหาร | ||||||||||||
|
||||||||||||
|
เมื่อต่อมไทรอยด์อิ่มตัวด้วยไอโอดีนไม่มีรังสีแล้ว จะดูดกลืนไอโอดีน-131 ได้น้อยมาก จึงเป็นการหลีกเลี่ยงการเกิดอันตรายจากการได้รับไอโอดีนกัมมันตรังสีได้ วิธีการทั่วไปในการป้องกันการรับไอโอดีน-131 คือ การใช้โปแตสเซียมไอโอไดด์ (potassium iodide) ในผู้ที่มีความเสี่ยง ปริมาณที่ใช้ในผู้ใหญ่ คือ ให้รับประทานโปแตสเซียมไอโอไดด์ 130 มิลลิกรัมต่อวัน หรือแบ่งเป็นรับประทาน 65 มิลลิกรัม วันละ 2 ครั้ง เทียบเท่ากับได้รับไอโอดีน 100 มิลลิกรัม ซึ่งคิดเป็น 700 เท่าของปริมาณไอโอดีนในอาหารปกติ ที่จะได้รับ 0.15 มิลลิกรัมต่อวัน (150 ไมโครกรัมต่อวัน) การใช้ทางเภสัชและทางการแพทย์ |
||||||||||||
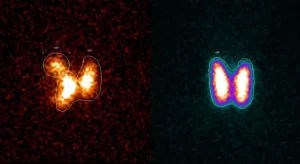
| มีการใช้ไอโอดีน-131 ทางการแพทย์ ในงานเวชศาสตร์นิวเคลียร์ และใช้ในการสแกนเพื่อวินิจฉัย เนื่องจากกลไกการดูดซึมไอโอดีน-131 จะไปสะสมที่เซลล์ปกติของต่อมไทรอยด์ ตัวอย่างการใช้ในงานรังสีรักษา (radiation therapy) ได้แก่ การใช้ไอโอดีน-131 ในการทำลายเนื้อเยื่อเซลล์มะเร็ง | ||||||||||||
|
||||||||||||
|
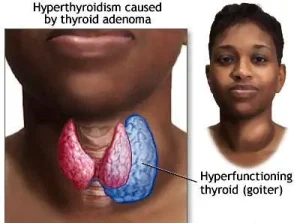
งานหลักอีกอย่างหนึ่งของการใช้ไอโอดีน-131 ได้แก่การรักษาภาวะฮอร์โมนไทรอยด์เกิน (thyrotoxicosis) หรือ (hyperthyroidism) และมะเร็งบางประเภทของต่อมไทรอยด์ที่ดูดกลืนไอโอดีนได้ หรือใช้รักษาภาวะไทรอยด์เกิน (hyperthyroidism) ที่เกิดจากโรคคอพอก (Grave’s disease) ที่บางครั้งไทรอยด์จะทำงานมากเกินไป (ต่อมไทรอยด์ทำงานผิดปกติแต่ไม่ได้เป็นเนื้องอก) มีการใช้ไอโอดีน-131 ในการติดฉลากสารกัมมันตรังสี (radioactive label) ในงานเภสัชรังสี (radiopharmaceuticals) สำหรับการรักษาโรค เช่น 131I-metaiodobenzylguanidine (131I-MIBG) สำหรับการรักษาและสร้างภาพรังสีในโรค pheochromocytoma และ neuroblastoma ซึ่งรังสีบีต้าที่มีพิสัยสั้นในไอโอดีน-131 จะเข้าไปทำลายเนื้อเยื่อ โดย 90% ของเนื้อเยื่อที่ถูกทำลายนั้นเกิดจากรังสีบีต้า ส่วนที่เหลือเกิดจากรังสีแกมมา ที่มีพิสัยยาวกว่า ซึ่งใช้ในการสแกนเพื่อการวินิจฉัยหลังจากการรักษาแล้วด้วย เนื่องจากผลของรังสีบีต้าสามารถเหนี่ยวนำให้เกิดมะเร็ง (carcinogenicity) กับต่อมไทรอยด์ได้ถ้าใช้ในปริมาณต่ำ จึงไม่ค่อยใช้ไอโอดีน-131 ในการวินิจฉัย (เมื่อก่อนมีการใช้กันมาก เนื่องจากไอโอดีน-131 ผลิตได้ง่ายและมีราคาไม่สูง) แต่ที่ใช้ในงานวินิจฉัยมากกว่าจะเป็นไอโอดีน-123 ซึ่งให้แต่รังสีแกมมา (ใช้ในงานเวชศาสตร์นิวเคลียร์สำหรับสแกนต่อมไทรอยด์) ไอโอดีน-125 มีครึ่งชีวิตที่ยาวกว่า จึงมักใช้ในงานที่ต้องการไอโซโทปรังสีครึ่งชีวิตยาว เช่น การรักษาด้วยการฝังแร่ (brachytherapy) โดยบรรจุไอโซโทปรังสีในแคบซูลโลหะขนาดเม็ดถั่วเล็กๆ ไอโอดีน-125 ให้รังสีแกมมาพลังงานต่ำ โดยไม่ให้รังสีบีต้า จึงใช้ประโยชน์ได้ดี ส่วนไอโซโทปรังสีอื่นของไอโอดีนยังไม่มีการนำมาใช้ในการรักษาด้วย brachytherapy ไอโอดีน-131 จากการใช้งานด้านการแพทย์ และของเสียที่ขับออกมาจากคนไข้ที่ได้รับการรักษา สามารถระบายลงในระบบกำจัดของเสียของโรงพยาบาลโดยตรงได้ การแยกตัวหลังจากการรักษา |
||||||||||||
| คนไข้ที่ได้รับการรักษาด้วยไอโอดีน-131 ไม่ควรมีเพศสัมพันธ์ประมาณ 1 เดือน (หรืออาจสั้นกว่านี้ ขึ้นกับปริมาณรังสีที่ใช้) และถ้าเป็นสตรีไม่ควรตั้งครรภ์ในเวลา 6 เดือนหลังจากได้รับการรักษา เพื่อไม่ให้เกิดความเสี่ยงที่จะมีผลต่อพัฒนาการของตัวอ่อน แม้ว่าปริมาณรังสีจะน้อยและไม่มีรายงานทางการแพทย์ว่ามีความเสี่ยงจากการรักษาด้วยไอโอดีนรังสี แต่ก็ควรป้องกันไว้ก่อนที่จะไม่ให้ตัวอ่อนทารกได้รับกัมมันตภาพรังสีโดยตรง และลดโอกาสที่จะตั้งครรภ์จากสเปอร์มที่อาจได้รับอันตรายจากรังสีจากไอโอดีน ข้อแนะนำเหล่านี้จะต่างกันในแต่ละโรงพยาบาลและขึ้นกับปริมาณรังสีที่ได้รับ นอกจากนั้น คนไข้ที่ได้รับไอโอดีนรังสี ไม่ควรกอดหรืออุ้มเด็ก ถ้าระดับรังสียังสูงอยู่ และควรเว้นระยะห่างไว้ประมาณ 1-2 เมตร | ||||||||||||
|
||||||||||||
|
ไอโอดีน-131 ในร่างกายจะลดลงไปด้วยบระบวนการสลายตัว ในระหว่างนี้ไอโอดีนบางส่วนจะถูกขับออกทางเหงื่อหรือปัสสาวะ จึงควรทำความสะอาดห้องน้ำ อ่างน้ำ ผ้าปูที่นอน และเสื้อผ้าของคนไข้ที่ใช้แล้ว เพื่อลดโอกาสที่คนในครอบครัวจะได้รับรังสีไปด้วยโดยเฉพาะในเด็ก ปัจจุบัน สนามบินหลายแห่งมีอุปกรณ์วัดรังสี เพื่อตรวจวัดการลักลอบนำวัสดุกัมมันตรังสีที่จะใช้ในการผลิตอาวุธนิวเคลียร์ คนไข้ที่ได้รับไอโอดีน-131 จึงควรระวังในการเดินทางด้วยเครื่องบิน ที่อาจถูกเครื่องวัดรังสีของสนามบินส่งสัญญาณเตือน ซึ่งอาจกินเวลายาวนานถึง 95 วัน ตั้งแต่ได้รับไอโอดีน-131 |
||||||||||||
| ถอดความจาก เวบไซต์ www.wikipedia.org |
||||||||||||