ไอโซโทปรังสีทางการแพทย์ |
||||||
|
ไอโซโทปรังสีคืออะไร (What are radioisotopes) มีธาตุหลายชนิดที่มีหลายไอโซโทป ไอโซโทปของธาตุ เป็นอะตอมที่มีจำนวนโปรตอน (เลขอะตอม) เท่ากัน แต่มีจำนวนนิวตรอนต่างกัน อิเล็กตรอนจะเป็นส่วนที่แสดงคุณสมบัติทางเคมีของอะตอม ในอะตอมที่เป็นกลางจะมีจำนวนอิเล็กตรอนเท่ากับเลขอะตอม มวลอะตอมเป็นผลรวมของโปรตอนกับนิวตรอน ในธรรมชาติมีธาตุทั้งหมด 92 ธาตุ และมีไอโซโทปเสถียรประมาณ 275 ไอโซโทป ถ้าผลิตไอโซโทปขึ้นมา โดยมีผลรวมของโปรตอนกับนิวตรอนไม่เหมือนับไอโซโทปที่มีในธรรมชาติ อะตอมนั้นจะไม่เสถียร และเรียกว่าไอโซโทปกัมมันตรังสี (radioactive isotope) หรือไอโซโทปรังสี (radioisotope) ในธรรมชาติมีไอโซโทปที่ไม่เสถียรเช่นกัน เป็นไอโซโทปที่เกิดจากการสลายตัวของ ยูเรเนียมและทอเรียม ไอโซโทปรังสีมีทั้งหมดประมาณ 1800 ไอโซโทป ปัจจุบันมีการนำไอโซโทปรังสีมาใช้ประมาณ 200 ชนิด เกือบทั้งหมดเป็นไอโซโทปที่เกิดจากการผลิตขึ้นมา ไอโซโทปรังสีสามารถผลิตได้หลายวิธี วิธีการทั่วไป คือการอาบด้วยรังสีนิวตรอน (neutron activation) ในเครื่องปฏิกรณ์ปรมาณู (nuclear reactor) เมื่อนิวเคลียสของอะตอมจับนิวตรอน จะทำให้อะตอมนั้นมีนิวตรอนมากเกินไป (neutron rich) ไอโซโทปรังสีบางชนิดผลิตด้วยไซโคลตรอน (cyclotron) โดยการยิงด้วยโปรตอน ทำให้นิวเคลียสนั้นมีนิวตรอนน้อยเกินไป (proton rich) นิวเคลียสของไอโซโทปรังสีจะกลับคืนสู่สภาวะเสถียร เมื่อคายรังสีออกมา เช่น รังสีอัลฟา รังสีบีตา หรือโพสิตรอน ไอโซโทปรังสีอาจจะคายอนุภาคเหล่านี้ออกมา โดยอาจจะให้ออกมาพร้อมกับพลังงานในรูปของคลื่นแม่เหล็กไฟฟ้า เช่น รังสีแกมมา กระบวนการนี้เรียกว่า การสลายตัวของกัมมันตภาพรังสี (radioactive decay) ผลิตภัณฑ์ที่มีกัมมันตภาพรังสีที่ใช้ในทางการแพทย์นี้ เรียกว่า เภสัชภัณฑ์รังสี (radiopharmaceuticals)
|
||||||
|
||||||
|
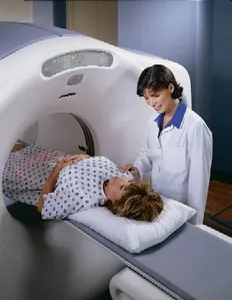
เวชศาสตร์นิวเคลียร์ (NUCLEAR MEDICINE) เวชศาสตร์นิวเคลียร์เป็นการแพทย์สาขาหนึ่ง ที่ใช้รังสีในการตรวจสอบการทำงานของอวัยวะในร่างกาย หรือใช้รังสีในการรักษาโรค โดยทั่วไปการปฏิบัติงานส่วนนี้จะทำโดยนักฟิสิกส์ เพื่อให้เกิดความรวดเร็วและความแม่นยำในการได้ข้อมูลมาประกอบการวินิจฉัยอาการของผู้ป่วย อวัยวะหลายส่วนสามารถทำให้มองเห็นภาพ และตรวจสอบความผิดปกติได้โดยง่าย เช่น ไทรอยด์ กระดูก หัวใจ ตับ ในบางกรณีรังสีสามารถใช้ในการรักษาโรค หรือเนื้องอกที่อวัยวะได้ ในประเทศที่พัฒนาแล้ว (26%ของประชากรโลก) มีความถี่ในการใช้เวชศาสตร์นิวเลียร์ในการวินิจฉัย 1.9% ต่อปี และมีความถี่ในการใช้ไอโซโทปรังสีในการรักษาประมาณ 1 ใน 10 ของจำนวนนี้ ทำให้การใช้เภสัชภัณฑ์ทางรังสี (radiopharmaceuticals) ในการวินิจฉัยมีจำนวนเพิ่มมากกว่า 10% ต่อปี เวชศาสตร์นิวเคลียร์เริ่มพัฒนาขึ้น ในช่วงปี 1950 โดยแพทย์นำมาใช้กับต่อมไร้ท่อ โดยเริ่มต้นที่การใช้ ไอโอดีน-131 ในการวินิจฉัยและรักษาโรคของต่อมไทรอยด์ ในเวลาไม่กี่ปีที่ผ่านมานี้ ผู้เชี่ยวชาญได้พัฒนามาใช้รังสี ในกระบวนการ dual CT/PET |
||||||
| การวินิจฉัย (DIAGNOSIS)
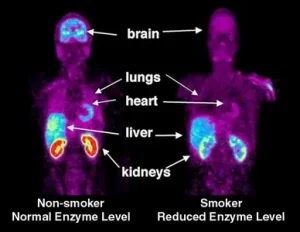
การวินิจฉัยด้วยเทคนิคทางเวชศาสตร์นิวเคลียร์ ใช้สารกัมมันตรังสี (radioactive tracers) ที่ให้รังสีแกมมาเข้าไปในร่างกายผู้ป่วย โดยทั่วไป สารรังสีเหล่านี้จะเป็นไอโซโทปที่มีอายุสั้น นำไปติดกับสารประกอบทางเคมี ที่สามารถเข้าไปในกระบวนการของร่างกาย ตรงตำแหน่งที่ต้องการได้ การนำเข้าไปในร่างกาย อาจใช้วิธีการฉีด การกิน หรือหายใจเข้าไป รังสีที่ออกมาจะถูกตรวจจับด้วย กล้องรังสีแกมมา (gamma camera) ทำให้สามารถมองเห็นอวัยวะด้วยมุมต่างๆ ได้หลายมุม กล้องจะสร้างภาพจากแต่ละจุดที่มีรังสีออกมา ภาพที่เกิดขึ้นสามารถปรับได้ด้วยคอมพิวเตอร์ ทำให้แพทย์สามารถมองเห็นและระบุความผิดปกติได้ การพัฒนา Positron Emission Tomography (PET) ที่ผ่านมา ทำให้มีการใช้ไอโซโทปที่ผลิตด้วยไซโคลตรอน (cyclotron) มาใช้ทางเวชศาสตร์นิวเคลียร์ได้อย่างถูกต้องและแม่นยำมากขึ้น นิวไคลด์รังสีที่ให้โพสิตรอน (positron-emitting radionuclide) จะถูกฉีดเข้าไปในร่างกาย และไปสะสมในเนื้อเยื่อของอวัยวะที่ต้องการตรวจสอบ การที่ไอโซโทปสลายตัวโดยให้โพสิตรอน ซึ่งจะเข้ารวมตัวอิเล็กตรอนแล้วกลายเป็นรังสีแกมมาที่มีพลังงานเท่ากันในทันที โดยเคลื่อนที่ไปในทิศตรงข้ามกัน PET camera สามารถตรวจจับรังสีแกมมา เพื่อหาตำแหน่งที่มาได้อย่างแม่นยำ ทำให้ PET กลายเป็นอุปกรณ์ที่สำคัญทางคลีนิกในการรักษาด้านเนื้องอก (oncology) โดยใช้สารรังสีฟลูออรีน-18 (fluorine-18) วิธีนี้ได้รับพิสูจน์แล้วว่า เป็นวิธีการที่มีการสูญเสียน้อยและมีความเที่ยงตรงที่สุด ในการตรวจวินิจฉัยโรคมะเร็งส่วนใหญ่ เทคนิคนี้ยังสามารถใช้ในการสร้างภาพของหัวใจและสมองเพื่อการวินิจฉัยด้วยเช่นกัน เทคนิคใหม่ในการรวมวิธี PET กับ CT scans โดยการประสานสองภาพเข้าด้วยกัน ทำให้สามารถวินิจฉัยได้ดีขึ้นกว่าการใช้ gamma camera อย่างเดียว 30% หลักการพื้นฐานของเวชศาสตร์นิวเคลียร์แตกต่างจากเทคนิคอื่น เช่น การถ่ายภาพด้วยรังสีเอกซ์ ตรงที่มีการทำให้เกิดภาพจากต้นกำเนิดรังสีภายในร่างกาย ภาพจากรังสีแกมมาจากวิธีนี้สามารถทำให้มองเห็นตำแหน่งและความเข้มข้นของไอโซโทปรังสีในร่างกาย อวัยวะที่มีความผิดปกติสามารถแสดงออกมาได้จากภาพของอวัยวะนั้น ที่มีตำแหน่งของรังสีต่ำ (cold spot) หรือสูง (hot spot) ถ้ามีการถ่ายภาพไว้เป็นชุดในช่วงเวลาหนึ่ง จะทำให้สามารถใช้รูปแบบที่ผิดปกติของไอโซโทปรังสี หรืออัตราการเคลื่อนที่ของไอโซโทปรังสี หาความผิดปกติของอวัยวะส่วนนนั้นได้ ความแตกต่างที่ชัดเจนของภาพถ่ายนิวเคลียร์กับกับภาพถ่ายรังสีเอกซ์คือ ภาพถ่ายนิวเคลียร์สามารถให้ภาพถ่ายที่ชัดเจนได้ทั้งกระดูกและเนื้อเยื่อในเวลาเดียวกัน ในประเทศพัฒนาแล้วจึงมีการใช้โดยทั่วไป เนื่องจากการถ่ายภาพครั้งเดียวสามารถนำไปใช้ตรวจสอบได้หลายกรณี กระบวนการวินิจฉัยแต่ละครั้ง ผู้ป่วยจะได้รับรังสีเฉลี่ย (mean effective dose) 4.6 mSv
|
||||||
|
||||||
| รังสีรักษา (RADIOTHERAPY) เซลล์ที่แบ่งตัวได้เร็วจะมีความไวและเกิดความเสียหายเมื่อได้รับรังสี ด้วยเหตุนี้ การฉายรังสีจึงสามารถยับยั้งการเจริญหรือทำลายเซลล์มะเร็งได้ โดยการฉายรังสีจากภายนอก สามารถใช้ลำรังสีจากสารกัมมันตรังสีโคบอลต์-60 (cobalt-60) ในประเทศพัฒนาแล้ว มักจะใช้เครื่องเร่งอนุภาคเชิงเส้น (linear accelerators) ซึ่งให้รังสีเอกซ์พลังงานสูงมากกว่า (รังสีเอกซ์และรังสีแกมมาเป็นคลื่นแม่เหล็กไฟฟ้าเช่นเดียวกัน) รังสีรักษาแบบภายใน (Internal radiotherapy) จะใช้วิธีการสอดหรือฝังต้นกำเนิดรังสีขนาดเล็กในตำแหน่งที่ต้องการรักษา รังสีที่ใช้มักเป็นรังสีแกมมาหรือรังสีบีตา ไอโอดีน-131 (Iodine-131) เป็นต้นกำเนิดที่ปกติใช้ในการรักษามะเร็งของต่อมไทรอยด์ ซึ่งนับเป็นการรักษามะเร็งที่ได้ผลดีที่สุด นอกจากนั้นยังนำไปใช้รักษาความผิดปกติของต่อมไทรอยด์ที่ไม่ใช่เนื้องอกด้วยเช่นกัน การฝังอิริเดียม-192 (Iridium-192) จะใช้ในกรณีพิเศษเฉพาะที่ศีรษะและทรวงอกเท่านั้น โดยทำเป็นเส้นลวดแล้วสอดลงไปที่ตำแหน่งที่ต้องการ เมื่อจุดที่ทำการรักษาได้รับรังสีตามปริมาณที่กำหนดแล้ว จึงนำออกมาเก็บไว้ในภาชนะบรรจุ การรักษาด้วยวิธี brachytherapy แบบระยะสั้นนี้ ทำให้ผู้ป่วยได้รับรังสีเฉพาะที่ ลดค่าใช้จ่ายและทำให้ได้รับรังสีทั่วร่างกายน้อยลง การรักษามะเร็งเม็ดเลือด (leukaemia) อาจจำเป็นต้องเปลี่ยนถ่ายไขกระดูก ในกรณีนี้ต้องทำลายไขกระดูกเดิมด้วยรังสีก่อน แล้วจึงนำไขกระดูกที่ดีเข้าไปแทนที่ กระบวนการรักษาในหลายกรณีจะเป็นการลดความเจ็บปวด เช่น การใช้ strontium-89 และ samarium 153 ใช้สำหรับลดความเจ็บปวดของมะเร็งกระดูก โดยผลิตภัณฑ์ใหม่ที่เริ่มมีการใช้ ได้แก่ rhenium-186 Targeted Alpha Therapy (TAT) เป็นเทคนิคใหม่ในการควบคุมการแพร่กระจายของมะเร็ง โดยใช้สารประกอบที่เป็นตัวพา (carrier) นิวไคลด์กัมมันตรังสีที่ให้รังสีอัลฟาไปยังตำแหน่งที่ต้องการ รังสีอัลฟาพลังงานสูงมีพิสัยหรือระยะทางในเนื้อเยื่อสั้นมาก ทำให้พลังงานของรังสีเกือบทั้งหมดจะส่งไปที่เซลล์มะเร็ง การใช้เทคนิคนี้สำหรับการรักษา leukaemia , cystic glioma และ melanoma กำลังอยู่ระหว่างการศึกษาในห้องปฏิบัติการและการทดสอบทางคลินิก มีการพัฒนาในการทดลองการรักษาโดยเทคนิคการจับนิวตรอนของโบรอน (Boron Neutron Capture Therapy) โดยใช้ boron-10 ฉีดเข้าไปในร่างกายผู้ป่วย ให้ไปสะสมที่เซลล์มะเร็งในสมอง (malignant brain tumour) เมื่อฉายรังสีเทอร์มัลนิวตรอนให้ผู้ป่วย โบรอนจะดูดกลืนนิวตรอน แล้วให้อนุภาคอัลฟาพลังงานสูงออกมาทำลายเซลล์มะเร็ง การใช้เทคนิคนี้ จำเป็นต้องส่งผู้ป่วยไปฉายรังสีนิวตรอนจากเครื่องปฏิกรณ์นิวเคลียร์ (nuclear reactor) แทนการใช้ไอโซโทปรังสี กระบวนการรักษาแต่ละวิธี มีวัตถุประสงค์ในการควบคุมให้ผู้ป่วยได้รับรังสีเฉพาะในบริเวณที่กำหนด โดยทั่วไปปริมาณรังสีต่อการรักษาแต่ละครั้งจะอยู่ระหว่าง 20-60 Gy |
||||||
| การวิเคราะห์ทางชีวเคมี (BIOCHEMICAL ANALYSIS) การตรวจสอบว่ามีสารกัมมันตรังสีอยู่หรือไม่ทำได้ไม่ยาก แม้ว่าจะมีเหลืออยู่น้อยมาก โดยไอโซโทปรังสีสามารถนำไปติดกับโมเลกุลของสารประกอบทางชีววิทยาแบบ in vitro (อยู่ภายนอกร่างกาย) นักพยาธิวิทยามีการทดสอบเพื่อหาสารประกอบในเลือด ซีรัม ปัสสาวะ ฮอร์โมน แอนติเจน และยาหลายชนิด ที่สามารถติดสารประกอบของไอโซโทปรังสีเข้าไปได้ วิธีการนี้เรียกว่า radioimmuno assays ซึ่งเป็นกระบวนการทางชีวเคมีที่ค่อนข้างซับซ้อน แต่เมื่อผลิตเป็นชุดสำหรับห้องปฏิบัติการแล้ว สามารถนำมาใช้ได้ง่ายและสามารถให้คำตอบได้อย่างถูกต้อง เภสัชภัณฑ์รังสีสำหรับการวินิจฉัย (DIAGNOSTIC RADIOPHARMACEUTICALS) อวัยวะทุกส่วนในร่างกายของเรามีผลต่อสารเคมีแต่ละชนิดแตกต่างกัน แพทย์และนักเคมีได้จำแนกสารเคมีที่แต่ละอวัยวะจะดูดกลืนไว้ออกมาเป็นจำนวนมาก ตัวอย่างเช่น ต่อมไทรอยด์จะรับไอโอดีน สมองต้องการกลูโคสจำนวนมาก ด้วยความรู้เหล่านี้ นักเภสัชรังสี (radiopharmacists) จึงสามารถติดไอโซโทปรังสีเข้ากับโมเลกุลของสารประกอบทางชีววิทยา เมื่อใส่สารประกอบนี้เข้าไปในร่างกาย จะเข้าสู่กระบวนทางชีววิทยาตามปกติ ก่อนจะถูกขับออกไปจากร่างกาย เภสัชภัณฑ์ทางรังสีสำหรับการวินิจฉัยสามารถใช้ในการทดสอบการไหลเวียนของเลือดไปยังสมอง การทำงานของตับ ปอด หัวใจและไต ใช้ประเมินการเจริญของกระดูก และใช้ยืนยันผลการวินิจฉัยจากวิธีอื่น นอกจากนั้นยังใช้ในการคาดหมายผลจากการผ่าตัด และประเมินการเปลี่ยนแปลงหลังจากการรักษา เภสัชภัณฑ์ทางรังสีที่ให้แก่ผู้ป่วยจะต้องมีปริมาณเพียงพอที่จะมีระดับอยู่ในเนื้อเยื่อของอวัยวะได้นานพอจะตรวจวัด เพื่อแสดงข้อมูลก่อนจะสลายตัวหมดไป ปริมาณรังสีที่ผู้ป่วยได้รับยังไม่มีระดับนัยสำคัญทางการแพทย์ เท่าที่ผ่านมายังไม่มีผู้ป่วยที่มีปัญหาจากรังสีในระหว่างการทดสอบหรือในภายหลัง จากการที่เป็นเทคนิคที่ไม่ทำให้บาดเจ็บ ประกอบกับความสามารถในการตรวจสอบการทำงานของอวัยวะได้จากภายนอกร่างกาย ทำให้เทคนิคนี้เป็นเครื่องมือในการวินิจฉัยที่มีประโยชน์อย่างยิ่ง ไอโซโทปรังสีที่ใช้สำหรับการวินิจฉัย ต้องสามารถปลดปล่อยรังสีแกมมาที่มีพลังงานสูงพอที่จะผ่านร่างกายออกมาได้ และต้องมีครึ่งชีวิตที่ไม่ยาวมาก โดยสามารถสลายตัวหมดไปได้หลังจากที่ได้ภาพถ่ายที่ต้องการแล้ว ไอโซโทปรังสีที่มีการใช้กันอย่างแพร่หลายที่สุด ได้แก่ technetium-99m โดยมีการใช้ประมาณ 80% ของปริมาณที่ใช้กระบวนการทางเวชศาสตร์นิวเคลียร์ หรือประมาณวันละ 40,000 ครั้ง ไอโซโทปนี้ผลิตขึ้นจากธาตุเทคนิเชียม (technetium) เป็นไอโซโทปที่มีคุณสมบัติเหมาะสมสำหรับใช้ในการสแกนทางเวชศาสตร์นิวเคลียร์ ดังนี้:
rubidium-82 สำหรับใช้กับการถ่ายภาพรังสีแบบ PET imaging ใช้ระบบการผลิต generator จาก strontium-82 ด้วยวิธีการที่คล้ายกัน โดยมีครึ่งชีวิต 25 วัน Myocardial Perfusion Imaging (MPI) ใช้ thallium-201 chloride หรือ technetium-99m ในการตรวจวินิจฉัยโรคเส้นเลือดตีบ (coronary artery disease) ในการถ่ายภาพรังสีแบบ PET imaging เภสัชภัณฑ์รังสีหลักคือ Fluoro-deoxy glucose (FDG) โดยใช้ F-18 ซึ่งมีครึ่งชีวิตต่ำกว่า 2 ชั่วโมง เป็น tracer โดย FDG จะถูกส่งเข้าไปในเซลล์โดยไม่ถูกทำลาย ทำให้ใช้เป็นตัวแสดงเมตาโบลิซึมของเซลล์ได้ด้วย ในการวินิจฉัยทางการแพทย์ มีแนวโน้มที่จะใช้เครื่องเร่งอนุภาคแบบไซโคลตรอนในการผลิตไอโซโทป (cyclotron-produced isotopes) มากขึ้น เช่นการผลิต F-18 สำหรับใช้ใน PET และ CT/PET โดยกระบวนการนี้ต้องใช้เวลาของ cyclotron ผลิตภายใน 2 ชั่วโมง |
||||||
|
|
||||||
| เภสัชภัณฑ์รังสีในการรักษา (THERAPEUTIC RADIOPHARMACEUTICALS)
ในบางกรณีของการรักษา แพทย์จำเป็นต้องใช้รังสีในการทำลายหรือทำให้เซลล์ที่มีความผิดปกตินั้นอ่อนแอลง ไอโซโทปรังสีจะให้รังสีออกมาจากตำแหน่งภายในอวัยวะที่ต้องการรักษาเช่นเดียวกับกรณีของการวินิจฉัย โดยไอโซโทปรังสีของธาตุจะถูกส่งเข้าไปในกระบวนการทางชีววิทยา หรือติดไอโซโทปรังสีของธาตุไปกับโมเลกุลของสารประกอบทางชีววิทยาที่เหมาะสม การรักษาด้วยรังสีที่มีพิสัยสั้นนี้เรียกว่า brachytherapy โดยส่วนใหญ่จะใช้รังสีบีตาในการทำลายเซลล์ที่ผิดปกติ ซึ่งกำลังกลายเป็นวิธีการรักษาหลักที่สำคัญ แม้ว่าทางการแพทย์จะมีการใช้รังสีรักษาน้อยกว่าการใช้ไอโซโทปรังสีในการวินิจฉัย แต่ก็กำลังเริ่มมีความสำคัญและแพร่หลายมากขึ้น หลักการของการใช้ไอโซโทปรังสีในการรักษา จะใช้ต้นกำเนิดรังสีบีตาความเข้มสูง และมีรังสีแกมมาพอที่จะทำให้เกิดภาพได้ เช่น ไอโซโทป lutetium-177 ซึ่งเตรียมจาก ytterbium-176 อาบรังสีนิวตรอนให้กลายเป็น Yb-177 แล้วสลายตัวเป็น Lu-177 ไอโซโทป Yttrium-90 ใช้สำหรับการรักษามะเร็ง โดยเฉพาะในกรณีของ non-Hodgkin’s lymphoma และการรักษาข้ออักเสบ (arthritis) มีการใช้ Iodine-131 และ phosphorus-32 ในการรักษาเช่นกัน โดย Iodine-131 ใช้รักษาต่อมไทรอยด์ที่เป็นมะเร็ง หรือมีอาการผิดปกติ เช่น hyperthyroidism (ต่อมไทรอยด์ทำงานมากเกินไป) การใช้ Phosphorus-32 ในการควบคุมโรค Polycythemia vera ซึ่งเกิดจากไขกระดูกผลิตเม็ดเลือดแดงมากเกินไป เทคนิคใหม่ที่ยังอยู่ในขั้นตอนของการทดลอง คือการใช้ boron-10 ส่งไปที่ก้อนเนื้องอก แล้วฉายรังสีนิวตรอนให้ผู้ป่วย โบรอนที่ดูดกลืนนิวตรอน จะให้รังสีอัลฟาพลังงานสูงออกมาทำลายเซลล์มะเร็ง เทคนิค targeted alpha therapy (TAT) ซึ่งมีการนำมาใช้แล้ว จะนำไอโซโทป actinium-225 ซึ่งสลายตัวมาจาก Bi-213 ติดไปกับโมเลกุลที่จะพาไปที่ตำแหน่งที่ต้องการ มีการวิจัยทางการแพทย์ที่เริ่มขยายตัวออกไปทั่วไป ในการใช้นิวไคลด์รังสีติดไปกับโมเลกุลทางชีววิทยา เพื่อส่งไปยังตำแหน่งที่ต้องการที่แน่นอน เช่น โมเลกุลของ immunoglobulin (monoclonal antibodies) การรักษาโดยส่งสารรังสีไปที่เซลล์เหล่านี้อาจจะนำไปสู่การลดหรือการรักษาผู้ป่วยบางโรคได้ดียิ่งขึ้น |
||||||
| ไอโซโทปที่ใช้ทางการแพทย์ (ISOTOPES USED IN MEDICINE) | ||||||
ไอโซโทปรังสีที่ผลิตโดยใช้เครื่องปฏิกรณ์ปรมาณู Reactor Radioisotopes (ครึ่งชีวิต)
|
||||||
|
||||||
ไอโซโทปรังสีที่ผลิตโดยใช้เครื่องเร่งอนุภาค (Cyclotron Radioisotopes)
|
||||||
|
||||||
| อ่านเพิ่มเติม www.vcharkarn.com/include/vcafe/showkratoo.php?Cid=29&Pid=36656 | ||||||
| ถอดความจาก Radioisotopes in Medicine เวบไซต์ http://www.world-nuclear.org/info/info.htm February 2006 |