|
เอกซเรย์ฟลูออเรสเซนต์ เป็นเทคนิคการวิเคราะห์ชนิดของธาตุและปริมาณธาตุในสารตัวอย่าง โดยอาศัยหลักการที่อิเล็กตรอนในวงโคจรของอะตอม เปลี่ยนระดับชั้นที่มีพลังงานสูงไปยังชั้นที่มีพลังงานต่ำกว่า และคายพลังงานออกมาในรูปของรังสีเอกซ์ที่มีพลังงานจำเพาะ (characteristic X ray) ของแต่ละธาตุ อิเล็กตรอนในวงโคจรของอะตอม แบ่งเป็นชั้น (shells) โดยชั้นในสุด ได้แก่ ชั้น K มีระดับพลังงาน (energy level) ต่ำสุด ถัดออกมา ได้แก่ ชั้น L, M, N, … ซึ่งจะมีระดับพลังงานสูงขึ้นตามลำดับ นอกจากอิเล็กตรอนในชั้น K ที่มีระดับพลังงานเดียวแล้ว อิเล็กตรอนในชั้นอื่น ยังแบ่งเป็นชั้นย่อย ได้แก่ LI, LII, LIII และ MI, MII, MIII, MIV, MV ซึ่งอะตอมของธาตุแต่ละชนิด จะมีความแตกต่างของพลังงานของอิเล็กตรอนในแต่ละชั้นไม่เท่ากัน |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
อิเล็กตรอนในแต่ละชั้นของวงโคจร มีพลังงานยึดเหนี่ยว (binding energy) ที่ได้รับจากนิวเคลียสแตกต่างกัน อิเล็กตรอนวงในที่อยู่ใกล้นิวเคลียส จะได้รับพลังงานยึดเหนี่ยวมากกว่าอิเล็กตรอนวงนอก และธาตุที่มีเลขอะตอม (Z) สูงขึ้น จะมีพลังงานยึดเหนี่ยวต่ออิเล็กตรอนมากขึ้น ดังตารางที่ 1 ตารางที่ 1 พลังงานยึดเหนี่ยวในหน่วยอิเล็กตรอนโวลต์ (eV) ของอิเล็กตรอนในแต่ละชั้น |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
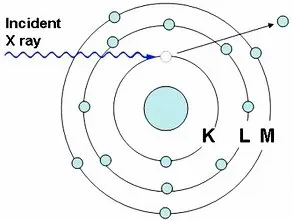
เมื่อยิงรังสีเอกซ์ รังสีแกมมา อิเล็กตรอน หรือโปรตอนไปยังอะตอมของธาตุ จะชนกับอิเล็กตรอนในวงโคจรและทำให้อิเล็กตรอนหลุดออกไปจากอะตอม ทำให้ตำแหน่งนั้นว่าง อิเล็กตรอนในชั้นที่มีพลังงานสูงกว่าจะเข้ามาแทนที่ เช่น จากชั้น L ไปชั้น K จากชั้น M ไปชั้น K หรือจากชั้น M ไปชั้น L โดยคายพลังงานส่วนเกินออกมาในรูปของรังสีเอกซ์ที่มีพลังงานจำเพาะ (characteristic X-ray) ของแต่ละธาตุ |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
รูปที่ 2 (a) รังสีเอกซ์พลังงานสูงทำให้อิเล็กตรอนในชั้น K หลุดออกไปจากวงโคจร |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
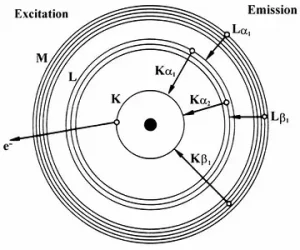
รังสีเอกซ์จำเพาะ (characteristic X-ray) ที่เกิดจากอิเล็กตรอนในชั้นที่สูงกว่า ลงไปแทนที่ว่างในชั้น K เรียกว่า K radiation หรือ K X-ray และเรียกว่า L radiation หรือ L X-ray ถ้าเป็นรังสีเอกซ์ที่เกิดจากอิเล็กตรอน ลงไปแทนที่ว่างในชั้น L โดยส่วนใหญ่อิเล็กตรอนที่หลุดออกไปจากวงโคจรจะเป็นอิเล็กตรอนในชั้น K ทำให้รังสีเอกซ์จำเพาะที่คายออกมา มีความเข้มของ K X-ray มากกว่า L X-ray รังสีเอกซ์จำเพาะจากอิเล็กตรอนในชั้นที่สูงกว่าหนึ่งระดับจะกำกับด้วยเครื่องหมาย a |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 รูปที่ 3 สัญลักษณ์ของรังสีเอกซ์จำเพาะจากการเปลี่ยนชั้นของอิเล็กตรอน |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
รังสีเอกซ์จำเพาะจากอิเล็กตรอนในชั้นย่อยของแต่ละระดับที่ลงไปแทนที่ว่าง จะกำกับเพิ่มด้วยหมายเลข เช่น อิเล็กตรอนจากชั้นย่อยของ LIII ไป K = Ka1 และ LII ไป K = Ka2
หรือ MV ไป LIII = La1 และ MIV ไป LIII = Ka2 นอกจากนั้น รังสีเอกซ์จากอิเล็กตรอนจากชั้นอื่นที่ลงมาแทนที่ จะมีเครื่องหมายและหมายเลขกำกับแตกต่างกัน เช่น Kb1, Kb2, Lb1, Lb2, Lg1, Lg2 ดังรูปที่ 4 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
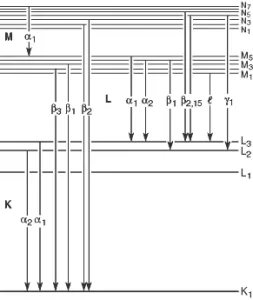 รูปที่ 4 สัญลักษณ์ของรังสีเอกซ์จำเพาะจากการเปลี่ยนชั้นของอิเล็กตรอน |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
รังสีที่ทำให้อิเล็กตรอนหลุดจากอะตอม จะต้องมีพลังงานสูงกว่าพลังงานยึดเหนี่ยวของอิเล็กตรอน หรือ แอบซอร์บชันเอดจ์ (absorption edge) โดยจะมีสัมประสิทธิ์ในการเกิดปฏิกิริยาสูงสุดเมื่อมีพลังงานใกล้กับ absorption edge และจะมีค่าลดลงเมื่อรังสีที่เข้าทำปฏิกิริยามีพลังงานสูงขึ้น โดยมีค่าแตกต่างกันสำหรับอิเล็กตรอนแต่ละชั้นและแตกต่างกันในแต่ละธาตุ ดังรูปที่ 5
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
รูปที่ 5 (a) แอบซอร์บชันเอดจ์ของอิเล็กตรอนในชั้น K, L, M และ (b) แอบซอร์บชันเอดจ์ของคาร์บอน ไนโตรเจนและออกซิเจน
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
การหาชนิดของธาตุ สามารถทำได้โดยการวิเคราะห์พลังงานของรังสีเอกซ์จำเพาะ ขณะที่การหาปริมาณธาตุ สามารถทำได้โดยการวิเคราะห์ความเข้มของรังสีเอกซ์ที่คายออกมา ตารางที่ 2 แสดงค่าของ absorption edge ของอิเล็กตรอนในชั้น K และชั้น L และค่าของพลังงานรังสีเอกซ์จำเพาะของแต่ละธาตุ ตารางที่ 2 แอบซอร์บชันเอดจ์ (absorption edge) และพลังงานของรังสีเอกซ์จำเพาะ (keV) ของธาตุ |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
การวิเคราะห์โดยวิธีเอกซเรย์ฟลูออเรสเซนต์ โดยทั่วไป จะทำให้อิเล็กตรอนหลุดออกจากอะตอม โดยใช้รังสีเอกซ์พลังงานสูงจากหลอดรังสีเอกซ์ (X-ray tube) หรือไอโซโทปรังสี (radioisotpe) ที่ให้รังสีเอกซ์ หลอดรังสีเอกซ์ประกอบด้วยไส้หลอด (filament) ที่เป็นแคโทด (cathode) หรือขั้วลบ และแอโนด (anode) หรือขั้วบวกที่มีความต่างศักย์สูง (high voltage) ทำด้วยโลหะที่มีเลขอะตอมสูงและทนความร้อนได้ดี เช่น W, Mo หรือ Rh เมื่อป้อนไฟฟ้าเข้าไป จะทำให้เกิดความร้อนที่คาโทดและมีอิเล็กตรอนหลุดออกมา ความต่างศักย์จะทำให้อิเล็กตรอนเคลื่อนที่เข้าชนแอโนดที่เป็นเป้า (target) และปล่อยรังสีเอกซ์แบบต่อเนื่อง หรือเบรมสตราห์ลุง (Bremsstrahlung) ออกมา โดยมีความเข้ม (I) แปรผันตามกระแสไฟฟ้า (i) ศักย์ไฟฟ้า (V) และเลขอะตอม (Z) ของธาตุที่ใช้ทำแอโนด ตามสมการ I = kiZV2 โดย k เป็นค่าคงที่ |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ไอโซโทปรังสีที่ใช้ในงานเอกซเรย์ฟลูออเรสเซนต์ เป็นไอโซโทปที่ให้รังสีเอกซ์ ได้แก่ Fe-55, Cd-109, Am-241 และ Pu-238 ซึ่งมีลักษณะเป็นวงแหวนหรือบรรจุอยู่ในตลับที่มีช่องเปิดดังรูปที่ 7 โดยมีคุณสมบัติ ดังตารางที่ 3 ตารางที่ 3 ต้นกำเนิดรังสีเอกซ์แบบไอโซโทปรังสี |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
รังสีเอกซ์ที่ให้ออกมาจากแต่ละธาตุในตัวอย่าง สามารถวิเคราะห์พลังงานของรังสี เพื่อหาชนิดของธาตุ และวิเคราะห์ความเข้มของรังสีเพื่อหาปริมาณธาตุได้โดยใช้หัววัดรังสีเอกซ์แบบก๊าซ (gas ionization chamber) ชนิด proportional counter หัววัดรังสีแบบเปล่งแสง (scintillation counter) หรือหัววัดรังสีแบบสารกึ่งตัวนำ ซึ่งโดยทั่วไปจะใช้หัววัดชนิดซิลิกอน(ลิเทียม): Si(Li) หรือเจอร์มาเนียมบริสุทธิ์สูง : HPGe |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
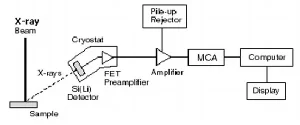
อุปกรณ์ที่ใช้ในการวัดรังสีเอกซ์โดยทั่วไป ประกอบด้วยหัววัดรังสี (detector) ส่วนสร้างสัญญาณ (preamplifier) ส่วนขยายสัญญาณ (amplifier) ส่วนวิเคราะห์สัญญาณ (multichannel analyzer) หรือ MCA ประกอบกับคอมพิวเตอร์ที่มีโปรแกรมประมวลผลและแสดงผลการวิเคราะห์ ดังรูปที่ 9
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
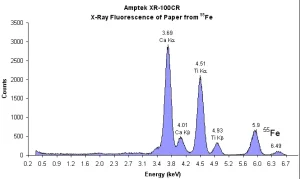
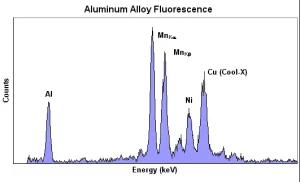
รังสีเอกซ์พลังงานสูงจากต้นกำเนิดรังสีเอกซ์แบบไอโซโทปหรือหลอดรังสีเอกซ์ ที่ตกกระทบตัวอย่าง จะทำให้ธาตุที่อยู่ภายในตัวอย่างปลดปล่อยรังสีเอกซ์จำเพาะของแต่ละธาตุออกมา ซึ่งแสดงผลการวัดเป็นแถบพลังงาน หรือสเปกตรัมของรังสีเอกซ์ ดังรูปที่ 10 และรูปที่ 11 ตำแหน่งที่แสดงผลการวัดรังสีเอกซ์ของแต่ละธาตุ เรียกว่า โฟโตพีค (photopeak) ซึ่งมีพื้นที่ของพีค (peak area) เป็นค่านับวัด (count) ของรังสีเอกซ์ ที่มีค่าแปรผันตามปริมาณธาตุในตัวอย่าง
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 (a)
(a)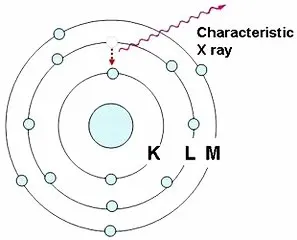 (b)
(b)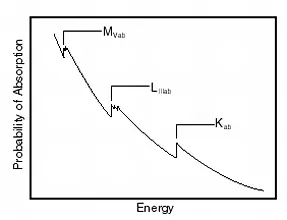 (a)
(a)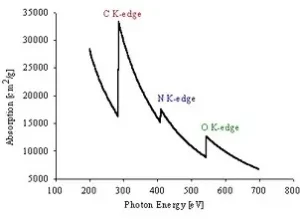 (b)
(b)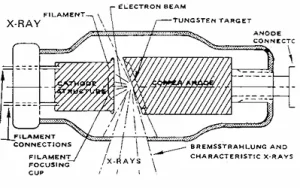

 (a)
(a) (b)
(b)